1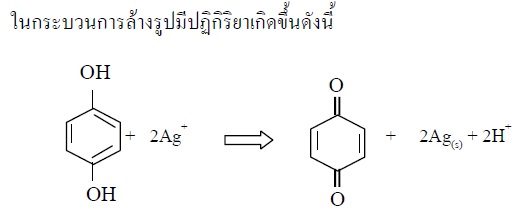 สารใดเกิดปฏิกิริยารีดักชัน
สารใดเกิดปฏิกิริยารีดักชัน
 สารใดเกิดปฏิกิริยารีดักชัน
สารใดเกิดปฏิกิริยารีดักชัน
ก.
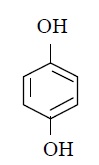
ข.
Ag+
ค.
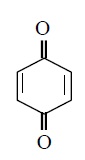
ง.
Ag
2

ก.
ข.
ค.
ง.
3สารละลายโพแทสเซียมไนเตรทเข้มข้น 0.100 โมลต่อลิตร จำนวน 1.00 ลิตร ผสมกับสารละลาย
แคลเซียมไนเตรทเข้มข้น 0.100 โมลต่อลิตร จำนวน 1.00 ลิตร ความเข้มข้นของไนเตรท
ไอออนในสารละลายหลังผสมเป็นกี่โมลต่อลิตร
ก.
0.0500 mol L-1
ข.
0.100 mol L-1
ค.
0.150 mol L-1
ง.
0.200 mol L-1
4คู่ใดแทนอันยรูป (allotropes) ของธาตุ
ก.
14C และ 12C
ข.
1 – เฮปทานอล และ 2-เฮปทานอล
ค.
Fe2+ และ Fe3+
ง.
O2 และ O3
5เตรียมสารละลายโซเดียมคลอไรด์ดังนี้
นำโซเดียมคลอไรด์ 5.85 กรัมละลายในน้ำแล้วทำให้มีปริมาตรเป็น 250
ลูกบาศก์เซนติเมตร
สารละลายโซเดียมคลอไรด์นี้มีความเข้มข้นกี่โมลต่อลิตร
(มวลอะตอมของ Na = 23, CI = 35.5)
ก.
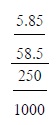
ข.
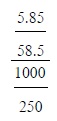
ค.
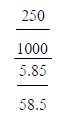
ง.
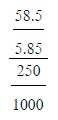
6เมื่อเติมโลหะทองแดงลงในสารละลายกรดซัลฟิวริก
สมการใดถูกต้อง
ก.
Cu + H2SO4 → CuSO4 +
SO2 + H2O
ข.
Cu + 2H2SO4 →
CuSO4 + SO2 + 2H2O
ค.
Cu + 2H2SO4 → Cu(SO4)2 + SO2 +
2H2O
ง.
2Cu + H2SO4 →
Cu2SO4 + SO2 + H2O
7ค่าคงที่การละลายของเกลือเงินสองชนิดเป็นดังนี้
ซิลเวอร์คลอไรด์ (AgCl) Ksp = 2.0 × 10-10
ซิลเวอร์คาร์บอเนต (Ag2CO3) Ksp = 8.0 × 10-12
การละลายของเกลือเงินในหน่วยโมลต่อลิตรข้อใดถูก
ซิลเวอร์คลอไรด์ (AgCl) Ksp = 2.0 × 10-10
ซิลเวอร์คาร์บอเนต (Ag2CO3) Ksp = 8.0 × 10-12
การละลายของเกลือเงินในหน่วยโมลต่อลิตรข้อใดถูก
ก.
AgCl ละลายได้มากกว่า Ag2CO3
ข.
Ag2CO3 ละลายได้มากกว่า AgCl
ค.
AgCl ละลายได้เท่ากับ Ag2CO3
ง.
AgCl และ Ag2CO3 ไม่ละลายน้ำ จึงคำนวณไม่ได้
21)
8ข้อมูลจากโจทย์
ข้อ 7 ในสารละลายโซเดียมคลอไรด์ เข้มข้น 0.10 โมลต่อลิตร จะละลาย
AgCl ได้กี่โมลต่อลิตร
ก.
2 x 10-10 mol
dm-3
ข.
2 x 10-9 mol
dm-3
ค.
1.4x 10-5 mol
dm-3
ง.
1.26 x 10-4 mol
dm-3
9เอโซเบนซีน
(C12H10N2)
เตรียมได้จากปฏิกิริยาต่อไปนี้
2 C6H5NO2 + 4 C6H14O4 → C12H10N2 + 4 C6H12O4 + 4 H2O
ถ้านำไนโตรเบนซีน (C6H5NO2) 123.0 g มาทำปฏิกิริยากับไตรเอทิลีนไกลคอล
2 C6H5NO2 + 4 C6H14O4 → C12H10N2 + 4 C6H12O4 + 4 H2O
ถ้านำไนโตรเบนซีน (C6H5NO2) 123.0 g มาทำปฏิกิริยากับไตรเอทิลีนไกลคอล
(C6H14O4) 325.0
g พบว่าเกิดเอโซเบนซีน 55.0 g ปฏิกิริยานี้มีสารใดเหลือ เหลือกี่กรัม
และมี
ผลได้ร้อยละเท่าใด
ก.
สารที่เหลือ : ไนโตรเบนซีน
ปริมาณที่เหลือ 10.25 g
ผลได้ร้อยละ 15.1
ปริมาณที่เหลือ 10.25 g
ผลได้ร้อยละ 15.1
ข.
สารที่เหลือ : ไนโตรเบนซีน
ปริมาณที่เหลือ 10.25 g
ผลได้ร้อยละ 30.2
ปริมาณที่เหลือ 10.25 g
ผลได้ร้อยละ 30.2
ค.
สารที่เหลือ :
ไตรเอทิลีนไกลคอล
ปริมาณที่เหลือ 12.50 g
ผลได้ร้อยละ 45.8
ปริมาณที่เหลือ 12.50 g
ผลได้ร้อยละ 45.8
ง.
สารที่เหลือ :
ไตรเอทิลีนไกลคอล
ปริมาณที่เหลือ 25.00 g
ผลได้ร้อยละ 60.4
ปริมาณที่เหลือ 25.00 g
ผลได้ร้อยละ 60.4
จ.
สารที่เหลือ :
ไตรเอทิลีนไกลคอล
ปริมาณที่เหลือ 25.00 g
ผลได้ร้อยละ 91.0
ปริมาณที่เหลือ 25.00 g
ผลได้ร้อยละ 91.0
10พิจารณาแก๊สต่อไปนี้
ก. ออกซิเจนจำนวน 6.02 ×1022 โมเลกุล
ข. คาร์บอนไดออกไซด์มวล 22.0 กรัม
ค. ฮีเลียม 1.0 โมล
ง. คลอรีนมวล 106.5 กรัม
จ. นีออนจำนวน 7.02 ×1023 อะตอม
แก๊สใดมีปริมาตรมากที่สุดที่ STP และถ้าให้แก๊สทั้งหมดในข้อ ก และ ข้อ ง ทำปฏิกิริยากันจะได้
ก. ออกซิเจนจำนวน 6.02 ×1022 โมเลกุล
ข. คาร์บอนไดออกไซด์มวล 22.0 กรัม
ค. ฮีเลียม 1.0 โมล
ง. คลอรีนมวล 106.5 กรัม
จ. นีออนจำนวน 7.02 ×1023 อะตอม
แก๊สใดมีปริมาตรมากที่สุดที่ STP และถ้าให้แก๊สทั้งหมดในข้อ ก และ ข้อ ง ทำปฏิกิริยากันจะได้
Cl2O
หนักกี่กรัม
ก.
แก๊สที่มีปริมาตรมากที่สุด
(dm3) : ข
น้ำหนัก Cl2O : 8.7 g
น้ำหนัก Cl2O : 8.7 g
ข.
แก๊สที่มีปริมาตรมากที่สุด
(dm3) : จ
น้ำหนัก Cl2O : 8.7 g
น้ำหนัก Cl2O : 8.7 g
ค.
แก๊สที่มีปริมาตรมากที่สุด
(dm3) : ค
น้ำหนัก Cl2O : 17.4 g
น้ำหนัก Cl2O : 17.4 g
ง.
แก๊สที่มีปริมาตรมากที่สุด
(dm3) : ง
น้ำหนัก Cl2O : 17.4 g
น้ำหนัก Cl2O : 17.4 g
จ.
แก๊สที่มีปริมาตรมากที่สุด
(dm3) : ก
น้ำหนัก Cl2O : 34.8 g
น้ำหนัก Cl2O : 34.8 g

ไม่มีความคิดเห็น:
แสดงความคิดเห็น